화학결합의 종류 및 예시 (이온결합, 공유결합, 금속결합)
화학결합은 화학 원자들이 상호작용하여 결합하여 화합물을 형성하는 방식입니다. 결합의 종류에 따라 세기와 성질이 달라집니다. 이번 포스팅에서는 이온결합, 공유결합, 금속결합의 정의와 그 예시에 대해 알아보도록 하겠습니다.
1. 이온결합 (Ionic Bond)
정의 : 이온결합은 금속원자와 비금속 원자간의 전자이동으로 형성되는 결합입니다. 여기서 금속원자들은 전자를 잃고 양이온(+)이 되고, 비금속 원자들은 반대로 전자를 얻으 음이온(-)이 됩니다. 양이온(+)과 음이온(-)의 강한 정전기적 인력에 의해 결합하는 것을 이온결합이라 합니다.
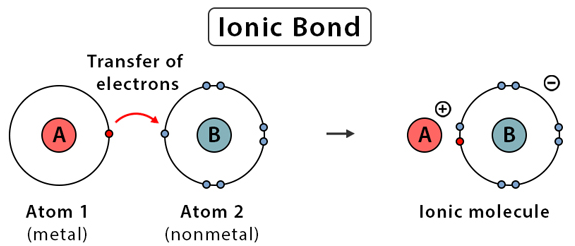
특징 :
높은 녹는점과 끓는점 : 양이온과 음이온 사이의 강한 정전기적 인력을 끊기 위해 많은 에너지 필요
물에 잘 녹음 : 물 분자의 극성이 이온을 둘러싸서 Hydration 되므로 결합이 쉽게 분리
용액상태에서 전기전도성 우수 : 용액에서 이온상태로 자유롭게 이동하여 전류 전달
고체상태에서 전기전도성 없음 : 고체상에서는 이온이 고정된 격자에 갇혀 있기에 전자 이동 불가
이온결합의 대표적인예 : NaCl (염화나트륨-소금), MgO(산화마그네슘)
2. 공유결합 (Covalent Bond)
정의 : 공유결합은 주기율표에서 비금속 원자들 사이에서 그들이 갖고 있는 전자를 '공유'하여 형성되는 결합입니다. 비금속원소 두 원자가 안정한 전자배치를 이루기 위하여 전자쌍을 공유하여 결합되며, 전자쌍의 개수에 따라 단일공유결합, 이중공유결합, 삼중공유결합으로 나타날 수 있습니다.
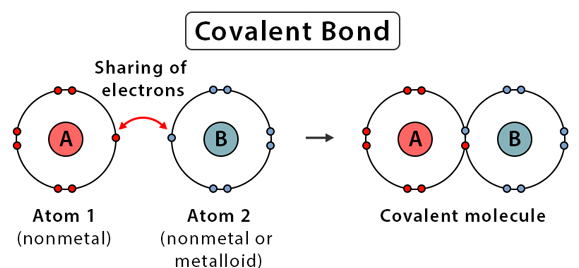
특징 : 낮은 녹는점과 끓는점, 물에 잘 녹지 않음 (극성제외)
낮은 녹는점과 끓는점 : 공유결합은 분자 내에서는 강한 결합을 이루지만, 분자간 인력은 낮기에 낮은 온도에서 분리
전기전도성이 낮음 : 자유전자가 없어 전자이동이 잘 되지 않아 전도성이 낮음
물에 잘 녹지 않음 (극성분자제외) : 비극성 공유결합 화합물은 극성인 물분자와 상호작용을 하지 않아 잘 녹지 않음
공유결합의 대표적인 예 : 물(H2O), 이산화탄소(CO2), 메탄(CH4)
3. 금속결합 (Metallic Bond)
정의 : 금속결합은 금속원자들이 자유전자구름을 공유하며 형성되는 결합입니다. 금속원자들은 양이온 형태로 배열되어 있고, 그 주위를 자유롭게 이동하는 전자들이 이를 결합하고 있습니다.

특징 :
높은 전기전도성 & 열전도성 : 금속의 자유전자가 전류와 열을 전달하는 매개체로 작용하여 전도성이 우수함
연성과 전성이 뛰어남 : 금속양이온들이 자유전자 구름 속에 떠 있는 구조를 이루고 있어서 외부로부터 힘이 가해져도 이온이 밀리지 않고 위치를 조정하여 형태 유지
특유의 광택을 가짐 : 자유전자가 빛을 반사하기 때문에 빛나는 광택을 보유
금속결합의 대표적인 예 : 구리(Cu), 철(Fe), 알루미늄(Al)
이번 포스팅에서는 이온결합, 공유결합, 금속결합에 대해 알아보았습니다. 해당 결합들의 특성을 배우면 화학반응과 물질 구조의 이해를 더욱 깊게 할 수 있습니다. 본 포스팅이 도움이 되길 바랍니다.